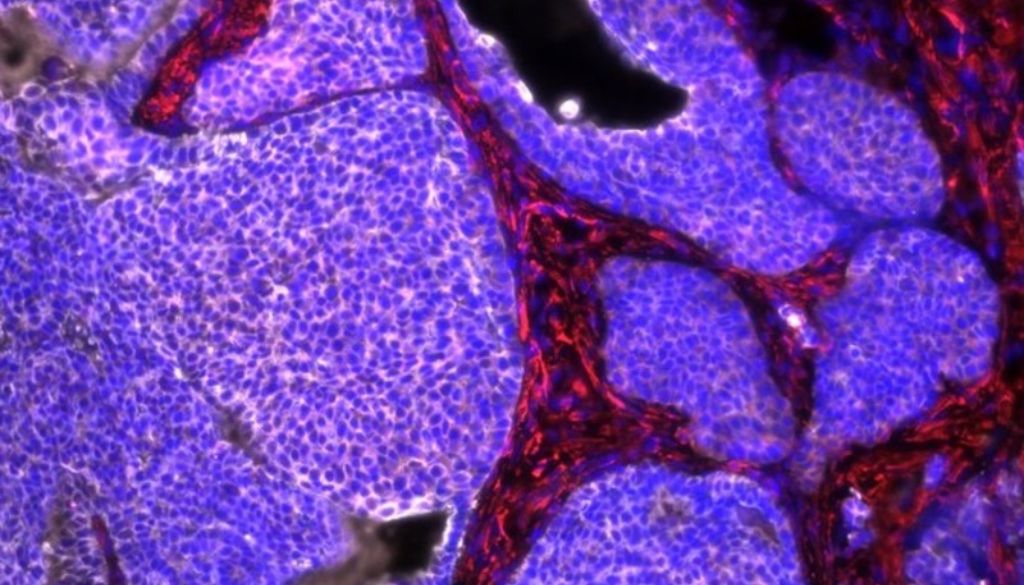
Un estudio desarrollado por científicos del Instituto de Estructura de la Materia del Consejo Superior de Investigaciones Científicas (IEM-CSIC) ha abierto una nueva vía para mejorar el tratamiento del cáncer de mama HER2+, uno de los más agresivos. La investigación, publicada en Scientific Reports, se basa en simulaciones computacionales de dinámica molecular que desentrañan el funcionamiento de una de las terapias más prometedoras contra este tipo de tumor: los anticuerpos conjugados a fármacos (ADC).
Los ADC son medicamentos que combinan la precisión de un anticuerpo monoclonal con la potencia de un fármaco de quimioterapia. El anticuerpo actúa como guía, uniéndose a una proteína específica en la superficie de las células tumorales, lo que permite que el fármaco llegue de manera directa y selectiva al tumor. Esta estrategia mejora la eficacia del tratamiento y reduce los efectos secundarios asociados a la quimioterapia convencional.
El trabajo del CSIC se centra en el llamado efecto bystander o “efecto espectador”, un proceso mediante el cual los ADC no solo atacan a la célula diana, sino también a las células tumorales vecinas, ampliando el alcance de la terapia. Sin embargo, los mecanismos que determinan este efecto aún no se comprenden completamente. “Nuestro objetivo fue analizar los factores que influyen en la capacidad de los ADC para extender su acción más allá de la célula inicial”, explicó Juan F. Vega, investigador del CSIC y coautor del estudio.
Entre los principales hallazgos, los científicos destacan que la carga eléctrica del fármaco es determinante para que este atraviese la membrana celular. Los medicamentos ionizados encuentran más barreras energéticas para difundirse, lo que reduce su eficacia. Además, la estructura del enlazador —el puente que une el anticuerpo con el fármaco— también juega un papel clave, ya que de su diseño depende la liberación del compuesto al medio extracelular para potenciar el efecto bystander.
Las simulaciones también identificaron un proceso celular, conocido como flip-flop, que limita la eficacia de los tratamientos. Este fenómeno implica el movimiento de moléculas en la membrana celular desde la fase acuosa hacia el núcleo hidrofóbico de la bicapa lipídica y viceversa, lo que dificulta la difusión del fármaco y reduce la efectividad de la terapia. “Hemos demostrado a nivel atómico cómo las propiedades físicoquímicas de los fármacos influyen directamente en su capacidad de penetrar en las células cancerosas”, destacó Vega.
Este avance forma parte del proyecto MOTHER (Misiles moleculares contra el cáncer de mama HER2), desarrollado en colaboración con la Fundación Contigo contra el Cáncer de la Mujer y con la participación de centros como el Institute of Oncology (IOB), el Hospital Beata María Ana de Madrid, el International Breast Cancer Center (IBCC) y la Clínica Teknon de Barcelona. El uso del supercomputador DRAGO del área de informática científica del CSIC ha sido fundamental para realizar estas simulaciones, que podrían reducir la necesidad de costosos ensayos experimentales en fases iniciales y acelerar el desarrollo de terapias más eficaces contra este tipo de cáncer.
No te pierdas una noticia, suscribete gratis para recibir DiarioSalud en tu correo, siguenos en Facebook, Instagram, Twitter, Linkedln, telegram y Youtube